INMUNOPATOLOGÍA E INMUNOTERAPIA PARA EL COVID-19
- Escrito por Dr. Jorge Luis Poo
- Publicado en Auto-inmunidad
Nuestras defensas dependen de los globulos blancos. En el caso de los virus, dependen en particular de un subgrupo de linfocitos. Por ello, es importante saber que una reducción en este tipo de células explicaría una disminución de la capacidad de defensa de los pacientes afectados. Entérate de cómo las alteraciones de los linfócitos podrían ser útiles para activar un nuevo plan terapéutico.
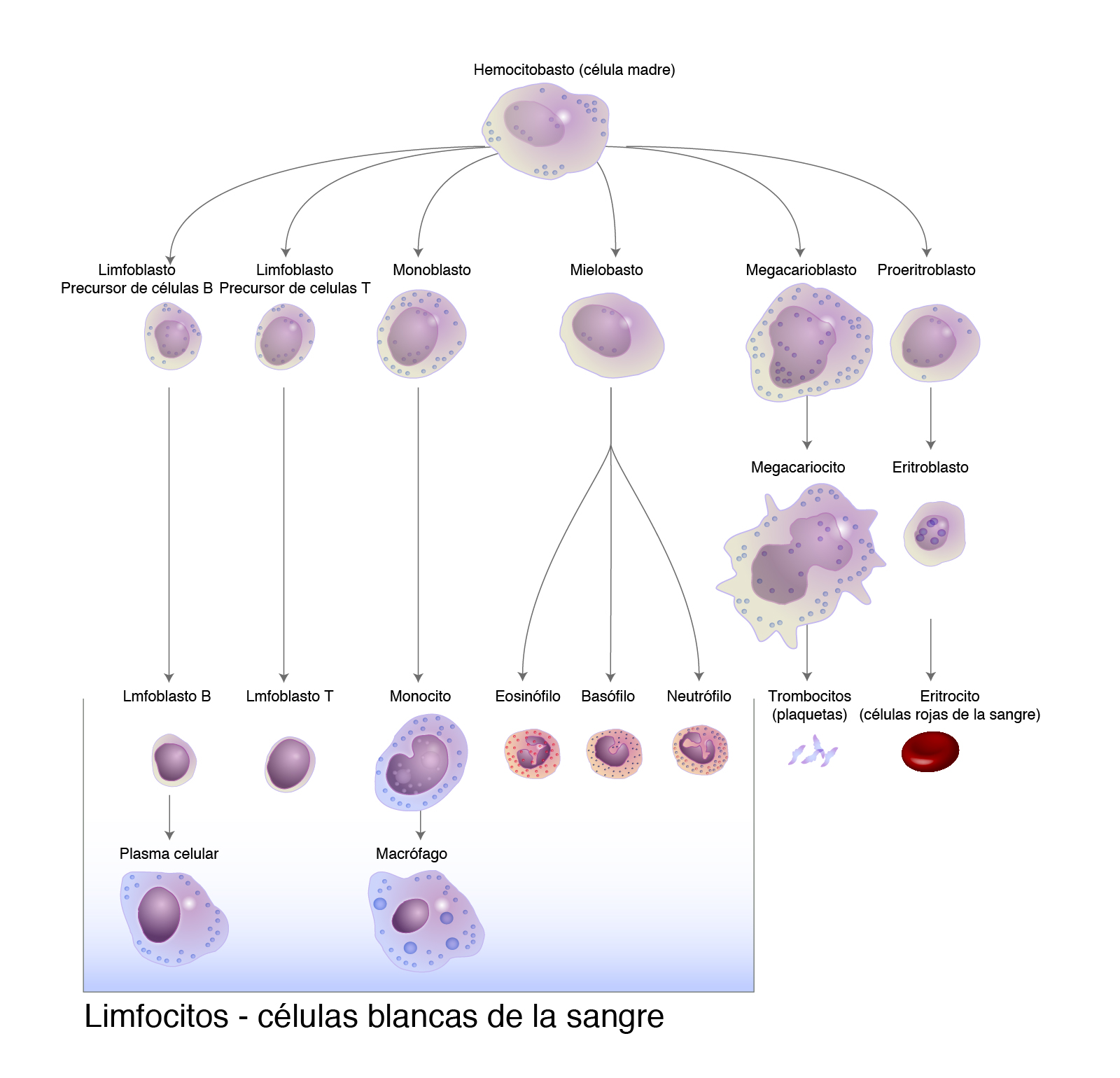 En el ser humano normal, disponemos de 5 a 10 mil leucocitos por cada 100 mL de sangre. Estos leucocitos o glóbulos blancos se dividen en granulocitos (neutrofilos, basófilos y eosinófilos) y linfocitos. Los primeros representan nuestra primera línea de defensa contra bacterias (particularmente los neutrófilos) y los eosinófilos se activan en caso de parásitos (como la amiba, la giardia, las lombrices, etcétera). Por otro lado, los linfocitos representan un sistema de defensa más sofisticado que depende de diversos mediadores moleculares.
En el ser humano normal, disponemos de 5 a 10 mil leucocitos por cada 100 mL de sangre. Estos leucocitos o glóbulos blancos se dividen en granulocitos (neutrofilos, basófilos y eosinófilos) y linfocitos. Los primeros representan nuestra primera línea de defensa contra bacterias (particularmente los neutrófilos) y los eosinófilos se activan en caso de parásitos (como la amiba, la giardia, las lombrices, etcétera). Por otro lado, los linfocitos representan un sistema de defensa más sofisticado que depende de diversos mediadores moleculares.
Según el Dr. Francesco Ciappelli, profesor emérito de la Universidad de California en Los Angeles, (UCLA, USA), comenta que en sujetos normales, cerca de un 70% de los linfocitos circulantes expresan un receptor en su membrana celular (TcR) que se asocia a un perfil de diferenciación celular diferente (en inglés se les llama Cluster of Diferentiation o CD). Los dos más importantes son los CD4+, CD8+. Los linfocitos que expresa CD4+ se les conoce como "cooperadores" y dan lugar a la activación de linfocitos B, a través de pequeñisimos medidadores moleculares llamados citocinas y que incluyen a las interleucinas (IL-2, IL-6) al factor de necrosis tumoral (TNF) capaces de activar una intensa reacción inflamatoria (tormenta de citocinas). Este tipo de respuesta es la habitual en infecciones por bacterias y/o parásitos.
Por otro lado, los linfocitos T CD8+ también desencadenan tormentas de citocinas, pero a expensas de moléculas llamadas "interferones" que actuan en forma citotóxica contra virus y células cancerosas. Una tercera población de linfocitos se llaman Linfocitos T reguladores (Tregs) que son capaces de inactivar a los Linfocitos CD4+, CD8+. Contienen un receptor llamado FoxP3 que respónde a otro tipo de citocinas, como la IL-10. En resumen, la respuesta inmune o de defensa a expensas de Linfocitos B o T, ya sea CD4+, CD8+ o bien FoxP3, debe ser armónica y finamente regulada para evitar respuestas inflamatorias excesivas (tormentas de citocinas) y lograr un estado llamado de homeostasis inmunológica. En pacientes mayores de 70 años se ha descrito un patrón inmune conocido como de inmunosenescencia e incluso algunos autores han acuñado el término de "linfocito exhausto" para referirse a un fenotipo en el cual los linfocitos reducen su función explicando la mayor susceptibilidad a infecciones en el adulto mayor.
En el caso de la infección por COVID-19, en las publicaciones originales de China, se han descrito una reducción de los linfocitos circulantes, hasta en el 82% de los pacientes. Por ello, el Dr. Bo Diao y colaboradores del Hospital General de Wuham, en la provincia de Hubei, en China, decidieron realizar una investigación para tratar de entender los factores involucrados en esta alteración de la respuesta inmune. Conviene aclarar que el trabajo está publicado en línea en una revista, sin revisores expertos, por lo cual se considera que sus conclusiones no deben ser utilizadas en la toma de decisiones clínicas.
Metodología: Se incluyeron un total de 522 pacientes con COVID 19, desde diciembre de 2019 a enero de 2020, así como un grupo control sano de 40 pacientes. En todos los participantes se midieron las concentraciones de linfocitos totales, de linfocitos T, linfocitos B, linfocitos NK y la subpoblación de CD4+. CD8+, así como concentraciones de citocinas IL2, IL4, IL6, IL10, TNF. Adicionalmente, en un subgrupo de pacientes se midieron la presencia de marcadores PD1 y TIM3, asociados al fenotipo de linfocico exhauto, de acuerdo a la técnica de citometría de flujo.
Resultados: Se logró tener cuentas linfocitarias de 499 pacientes y de los 40 controles sanos, con los siguientes hallazgos:
- En 359/499 (71.9%) se observó reducción de linfocitos totales.
- En 379/499 (75.9%) se observó reducción de linfocitos CD4+.
- En 357/499 (71.5%) se observó reducción de linfocitos CD8+.
- Las cuentas de linfocitos totales fueron menores en pacientes en Unidad de Terapia Intensiva (UTI) comparado con pacientes fuera de la UTI
- Los pacientes mayores de 60 años tenían mayor reducción de la cuenta de linfocitos totales
- Los pacientes que fallecieron tuvieron valores más bajos de linfocitos
- Los niveles de IL-6, IL-10 y TNF resultaron más elevados en los pacientes en la UTI que aquellos fuera de la UTI y se correlacionaron de manera inversa con la cuenta de leucocitos sugiriendo un rol inhibitorio de este exceso de citocinas sobre las cuentas celulares.
- Se detectó un incremento significativo de PD1 y TIM3 en los linfocitos de los pacientes en la UTI, sugiriendo la presencia de sistema inmune exhausto.
 Conclusiones: Los autores confirman que si existe un desequilibrio en la respuesta inmune sobre todo en los pacientes más graves, con infección por COVID-19 que amerita nuevas estrategias terapéuticas. Comentan que el anticuerpo conocido como TOCILIZUMAB que tiene la propiedad de inactivar a la IL-6 podría ser útil en este tipo de pacientes. Sin embargo, al momento actual se desconoce su eficacia en COVID 19 y se requieren estudios para demostrarlo. Sobre el origen del exceso de citocinas, en pacientes que tienen reducción en las cuentas de linfocitos, los autores mencionan que es posible que provengan de otro tipo de celulas denominadas monocitos y macrófagos alveolares. Finalmente, los autores mencionan que el origen de este estado "inmune exhausto" se relaciona con la infección viral, tal y como se había descrito en algunos modelos de hepatitis viral fulminante en roedores y por lo tanto es fundamental encontrar tratamientos antivirales exitosos.
Conclusiones: Los autores confirman que si existe un desequilibrio en la respuesta inmune sobre todo en los pacientes más graves, con infección por COVID-19 que amerita nuevas estrategias terapéuticas. Comentan que el anticuerpo conocido como TOCILIZUMAB que tiene la propiedad de inactivar a la IL-6 podría ser útil en este tipo de pacientes. Sin embargo, al momento actual se desconoce su eficacia en COVID 19 y se requieren estudios para demostrarlo. Sobre el origen del exceso de citocinas, en pacientes que tienen reducción en las cuentas de linfocitos, los autores mencionan que es posible que provengan de otro tipo de celulas denominadas monocitos y macrófagos alveolares. Finalmente, los autores mencionan que el origen de este estado "inmune exhausto" se relaciona con la infección viral, tal y como se había descrito en algunos modelos de hepatitis viral fulminante en roedores y por lo tanto es fundamental encontrar tratamientos antivirales exitosos.
Estos resultados ayudan a entender porqué a algunos pacientes les va tan mal y enfatizan la importancia de activar medidas tempranas de tratamiento. Además es probable que la combinación de acciones anti-inflamatorias y antivirales pueda ayudar al mejor tratamiento de los cuadros graves de infección por COVID-19 los cuales se asocian a riesgo alto de mortalidad.
Referencias:
1. Francesco Chiappelli, Allen Khakshooy, and Gillian Greenberg. CoViD-19 Immunopathology and Immunotherapy. Bioinformation 2020 Mar 31;16(3):219-222.
2. Huang C, Wang Y, Li X. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395:497–506
3. Wherry E.J. Kurachi M. Molecular and cellular insights into T cell exhaustion. Nat. Rev. Immunol. 2015; 15: 486-499.
4. Crooke SN, Ovsyannikova IG, Poland GA, Kennedy RB. Immunosenescence and human vaccine immune responses. Immun Ageing. 2019;16:25.
5. Bo Diao, Chenhui Wang, Yingjun Tan, Xiewan Chen, Ying Liu, Lifen Ning, Li Chen, Min Li, Yueping Liu, Gang Wang, Zilin Yuan, Zeqing Feng, Yuzhang Wu, Yongwen Chen. Reduction and Functional Exhaustion of T Cells in Patients with Coronavirus Disease 2019 (COVID-19). Med Rvix preprint 2020.
6. Stebbing J, Phelan A, Griffin I, Tucker C, Oechsle O, Smith D, et al. COVID-19: combining antiviral and anti-inflammatory treatments. Lancet Infect Dis. 2020;20(4):400–402


